7月11日,附属医院(临床医学院)脊柱外科孟纯阳教授团队在顶级期刊《Cell Death & Differentiation》(中科院一区TOP,影响因子15.4)上发表了最新研究成果《GLUL mediates FOXO3 O-GlcNAcylation to regulate the osteogenic differentiation of BMSCs and senile osteoporosis》。附属医院博士后张禄为第一作者。该研究首次揭示了谷氨酰胺合成酶(GLUL)通过调控FOXO3的O-GlcNAc糖基化修饰,改善骨髓间充质干细胞(BMSCs)成骨分化并缓解老年性骨质疏松症(Senile Osteoporosis, SOP)的全新分子机制,为开发针对SOP的创新疗法提供了重要的理论依据和潜在干预靶点。
老年性骨质疏松症是一种与年龄增长密切相关的骨骼退行性疾病,主要表现为骨量减少、骨微结构破坏和骨折风险增加。随着全球人口老龄化加剧,SOP发病率持续攀升,严重威胁老年人健康和生活质量。骨髓间充质干细胞(BMSCs)的成骨分化异常被认为是SOP的重要诱因之一,但其深层调控机制尚不明确。GLUL是合成谷氨酰胺的关键酶,但其在SOP中的作用此前未见报道。此外,O-GlcNAc糖基化修饰是近年来发现的一种重要的蛋白质翻译后修饰,参与众多生理病理过程,但其在BMSCs成骨分化中的具体调控机制仍需深入探索。孟纯阳教授科研团队长期致力于脊神经慢性压迫性疼痛、腰椎间盘退变及骨质疏松症领域的研究,始终坚持基础研究与转化应用研究并重,有力推动了医院科研创新与临床诊疗水平的协同提升。

该研究发现,来自SOP患者的BMSCs中GLUL表达显著下调,而在正常的BMSCs成骨分化过程中GLUL表达则上调。研究团队构建了间充质干细胞特异性敲除Glul基因的小鼠模型(GlulPrx1),观察到基因敲除乳鼠出现明显的颅骨和指骨发育异常,成年后其骨量显著减少(表现为骨体体积分数下降,骨小梁变少变细、间距增加),且GlulPrx1小鼠的BMSCs成骨分化能力(通过碱性磷酸酶ALP 活性、矿化能力检测)以及成骨标志物(如RUNX2、SPP1)表达均显著降低,直接证实了GLUL缺失会导致BMSCs成骨分化障碍。
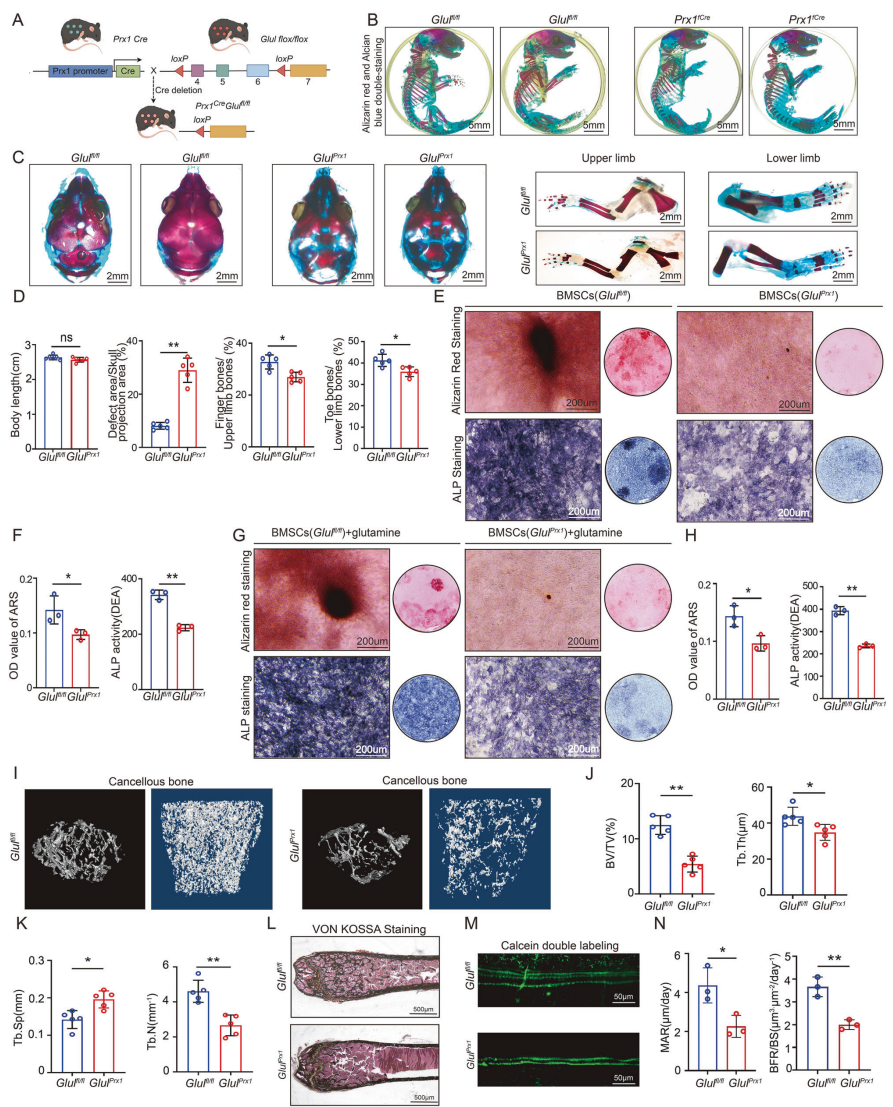
图1,间充质干细胞特异性敲除Glul导致小鼠骨发育异常(幼年)和骨质疏松(成年)
机制研究表明,GLUL通过竞争性结合E3泛素连接酶TRIM25的SPRY结构域,减少UDP-N-乙酰葡糖胺焦磷酸化酶1(UAP1)的泛素化降解,从而增加了糖基化底物UDP-GlcNAc的合成水平。以上过程进一步促进了转录因子FOXO3第296位丝氨酸(Ser296)的O-GlcNAc糖基化修饰,增强了FOXO3的稳定性,进而减轻细胞内的氧化应激损伤并促进BMSCs向成骨细胞分化。研究人员还观察到,SOP患者的BMSCs中FOXO3 Ser296位点的O-GlcNAc糖基化修饰明显水平降低;人为阻断小鼠BMSCs中FOXO3 Ser296的O-GlcNAc修饰,会显著抑制其成骨分化能力。
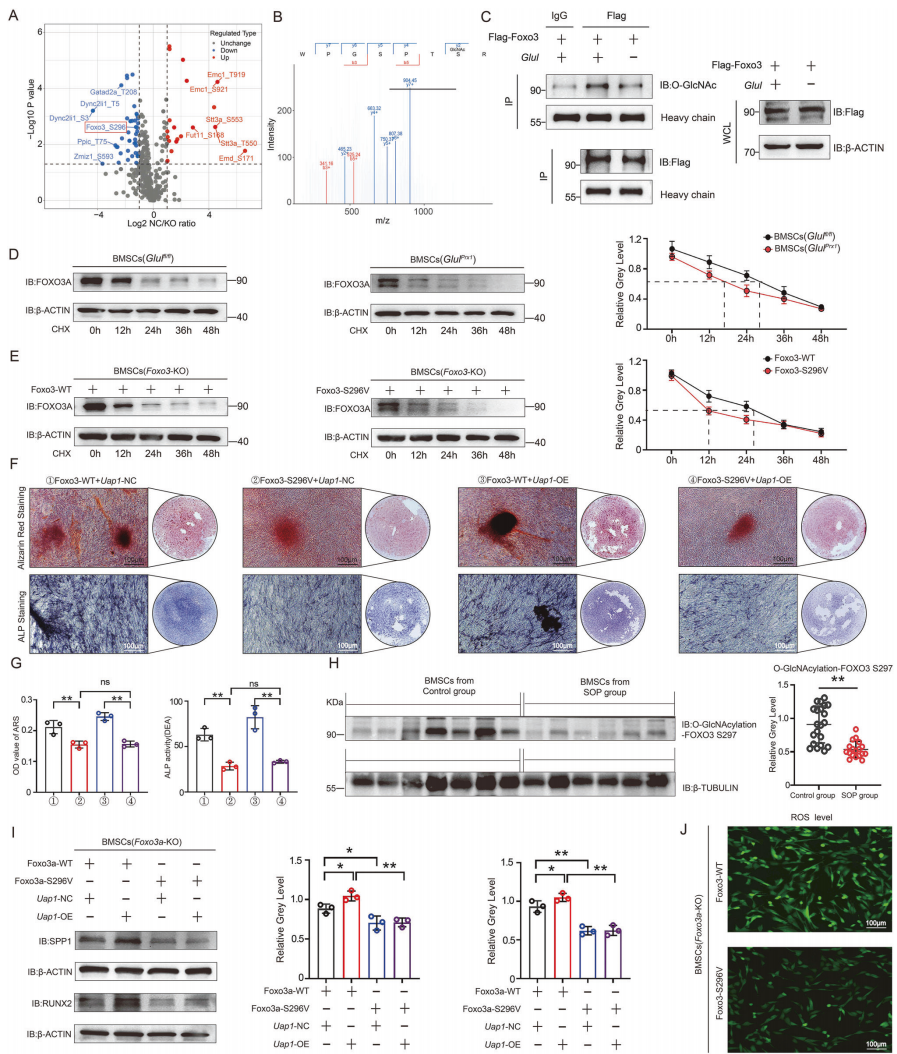
图2,GLUL调控FOXO3- Ser296位点的O-GlcNAc糖基化修饰,增强FOXO3稳定性
研究团队在SOP模型小鼠中进行了概念验证:通过靶向BMSCs补充GLUL,成功缓解了模型小鼠的骨丢失现象。这一结果强有力地支持了靶向GLUL及其下游信号通路作为治疗老年性骨质疏松症的全新策略的可行性,为未来临床转化(如开发激活GLUL或模拟其下游效应的药物)带来了希望。
原文链接
https://www.nature.com/articles/s41418-025-01543-2
【信息来源:附属医院(临床医学院) 撰稿:张禄、王坤鹏 责编:蒲丽娜 终审:张秋生】










